Общая характеристика фауны
Морские млекопитающие, подобно птицам, представлены в Белом море меньшим числом видом, чем в Баренцевом. Среди них наиболее значимы гренландский тюлень, белуха, кольчатая нерпа и морской заяц. Остальные морские млекопитающие встречаются гораздо реже, а некоторые из них – лишь эпизодически и единично.
Гренландский тюлень Pagophilus (Phoca) groenlandica Erxleben – обитатель самых северных окраин Атлантического океана и прилегающих акваторий Полярного бассейна. На востоке тюлени этого вида населяют Белое и Баренцево моря, заходя лишь частично в Карское море. На севере граница ареала проходит от архипелагов Земля Франца-Иосифа и Шпицберген до Северной земли. Западная часть ареала простирается от Баренцева моря через северную часть Норвежского моря и проливы Шпицбергена, северо-восточные и юго-западные районы Гренландского моря и тянется к Датскому проливу. Ареал захватывает прибрежные воды северной Ирландии и окаймляет восточное и западное побережье южной Гренландии. Западная часть ареала гренландского тюленя приходится на восточное побережье Баффиновой Земли и берега Лабрадора. Самая южная часть ареала охватывает со всех сторон о. Ньюфаундленд, включая залив Святого Лаврентия, шельф Новой Шотландии и район Большой Ньюфаундлендской банки (Чапский, 1948). Существуют три отдельных стада гренландских тюленей: ньюфаундлендское, ян-майенское и беломорское.
В конце зимы гренландские тюлени беломорского стада, или лысуны, как их было принято называть у поморов, возвращаются в Белое море после нагула и приступают к деторождению, образовав на льдах северо-восточной части Бассейна и юге Горла большие скопления (“детные залежки”).
Обычно у самки рождается один детеныш, весящий 7–8 кг (Арсеньев, 1980). Спустя несколько дней зеленоватая шкура новорожденного становится белоснежной, а тюлененок при этом превращается из «зеленца» в «белька». Самки кормят новорожденных в течение 20–25 суток, после чего покидают их навсегда. К окончанию периода молочного вскармливания масса детенышей увеличивается до 30–40 кг.
Оставив тюленят, самки объединяются с самцами на общих залежках и в конце марта–начале апреля приступают к спариванию (Виноградов, 1949). После этого тюлени линяют. На линных залежках в апреле их может скапливаться по несколько десятков и даже сотен тысяч (Тимошенко, 1995 а).
Перелинявших тюленей к середине мая выносит со льдами из Белого моря в Баренцево (Чапский, 1961). Вместе с ними место рождения покидают и молодые тюлени. За период дрейфа льдов подросшие сеголетки успевают перелинять, изменив цвет шкуры на серый, благодаря чему их называют «серками». К моменту выноса в Баренцево море тюленята становятся хорошими пловцами. Он способны нырять и самостоятельно добывать пищу (Тимошенко, 1995 а).
В течение всего пребывания в акватории Белого моря лысуны не питаются (Тимошенко, 1963, 1995 а). Это обстоятельство позволяет считать их воздействие на беломорские экосистемы минимальным и не рассматривать лысунов как потребителей вещества и энергии на верхних этажах трофических цепей. Однако, несмотря на это, целесообразно проанализировать динамику их запаса и промысла, что позволит наглядно проиллюстрировать антропогенное воздействие на биологические ресурсы моря.
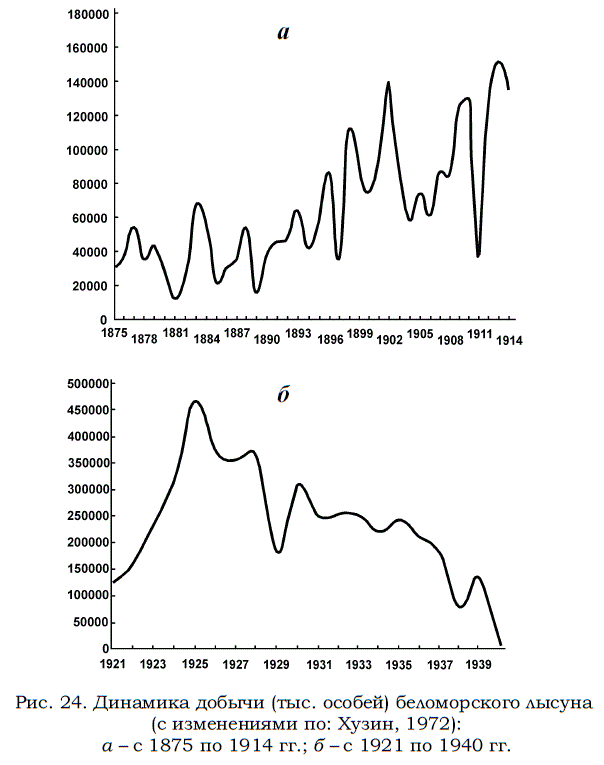
Отечественный промысел гренландского тюленя начался в XI–XII столетиях (Визе, 1948), но долгое время, вплоть до конца ХVIII века, был слабо развит и носил кустарный характер (Лепехин, 1805). В начале следующего столетия промысел лысуна начал усиливаться. Небольшие артели поморов, промышлявшие зверей на дрейфующих льдах, добывали в этот период около одного–двух десятков тысяч тюленей в год (Мишин, 2001). В первой половине XIX века по оценке Н.Я. Данилевского (1862) за год добывалось уже до 40–50 тыс. лысунов, но в среднем уровень добычи не превышал 27 тыс. голов в год. С начала XX столетия в промысле стали использовать суда, поначалу парусные, а затем и моторные. Число их быстро возрастало: в 1987 г. на промысле были впервые использованы 3 парусных судна, а в 1910 г. количество отечественных зверобойных судов увеличилось до 18. К этому следует добавить и большое количество зверобойных судов Норвегии, которые еще в первой половине XIX столетия начали промышлять гренландских тюленей в территориальных водах России – сначала в Баренцевом, а затем и в Белом море (Брейтфус, 1905). В 1912 – 1914 гг. добыча лысунов составила в среднем уже 139 тыс. голов в год, включая то, что было добыто и норвежскими судами. Во время Первой Мировой войны русскими промышленниками добывалось за год от 26 до 67 тыс. голов, а норвежцами – от 38 до 108 тыс. (Хузин, 1972). В следующем десятилетии суммарный для обеих стран уровень промысла еще повысился, достигнув среднегодовой величины в 348 тыс. животных. Максимум добычи тюленей пришелся на 1925 г. (рис. 24).
Рис. 24. Динамика добычи (тыс. особей) беломорского лысуна (с изменениями по: Хузин, 1972): а – с 1875 по 1914 гг.; б – с 1921 по 1940 гг.
По одним данным (Тимошенко, 1995 а) их число достигло 468 тыс. голов. По другим сведениям количество добытых лысунов было чуть больше 0.5 млн. голов (Савватиимский, 1935; Кузнецов, 1960). Вслед за этим добыча гренландских тюленей в Белом море начала довольно быстро снижаться (см. рис. 24,б).
В конце 30-х годов прошлого столетия промысел давал не более 138 тыс. голов, а в период Второй Мировой войны добыча снизилась до 36 тыс. животных в год (Яковенко, 1967). Новая интенсификация промысла лысуна после окончания войны привела к тому, что в 1951 г. было добыто 226 тыс. голов. В дальнейшем уровень промысла вновь понизился и в середине 60-х годов добывалось ежегодно около 60–70 тыс. тюленей (Яковенко, 1967, 1983).
Долгие годы запасом лысуна никто не интересовался. Первая попытка определения численности тюленей методом аэрофотосъемки, произведенная в 1927 г., относится к периоду максимального промысла тюленей (Дорофеев, Фрейман, 1928). По полученным данным численность стада достигала 3 млн. голов. На самом деле в расчетах была допущена серьезная ошибка, связанная с неверным определением доли в популяции половозрелых самцов («крыланов»), которых легко идентифицировать с самолета и по которым производился учет численности. В результате запас был завышен в несколько раз. Ошибочное мнение о численности лысунов, основанное на результатах этих расчетов, сохранялось довольно долго. В начале 50-х годов прошлого столетия запас тюленей был определен в размере 1.5 млн. голов (Сурков, 1957), тогда как на деле он был примерно в 6 раз меньше. После того как методическая ошибка была, наконец, устранена, материалы новых аэрофотосъемок 1962–1963 гг. показали, что реальная численность беломорского стада гренландского тюленя составляла всего 222.4 тыс. голов (Яковенко, 1967).
Очень низким оказалось и количество половозрелых самок (Яковенко, 1983). Сокращение их доли в популяции, обусловленное селективным отстрелом во время промысла (Назаренко, Яблоков, 1962), свидетельствовало о подрыве запаса и депрессии процессов воспроизводства лысуна, популяция которого в 1962–1965 гг. находилась на грани истребления (Яковенко, 1967, 1983). Одновременно с этим происходило и значительное сокращение добычи, снизившейся в 1965–1974 гг. до минимального уровня – 36 тыс. голов в год (Тимошенко, 1995 а).
Депрессия промысла и открывшиеся факты крайне низкой численности лысунов, свидетельствующие о катастрофическом состоянии популяции, заставили принять ряд срочных мер по восстановлению запаса гренландского тюленя. СССР и Норвегия подписали договор о ежегодных квотах добычи гренландского тюленя в Белом море и южной части Баренцева моря. В соответствии с его условиями была прекращена добыча размножающихся самок и резко сокращен (а впоследствии и вовсе прекращен) судовой промысел тюленей. Общая квота на добычу лысунов сократилась в несколько раз. За этим последовали и другие ограничительные меры, которые позволили спасти находившуюся на грани исчезновения беломорскую популяцию тюленей и постепенно привели к росту ее численности (Назаренко, 1974, 1984; Яковенко, 1983).
Увеличение численности беломорского стада гренландского тюленя было предсказано с помощью структурной модели популяции, адекватно оценивавшей изменения численности тюленей (Яковенко, 1967). Ее верификация по данным периодически повторявшихся аэрофотосъемок (1962–1976 гг.) показала, что численность тюленей отличалась от расчетной меньше, чем на 5%. Лишь в 1966 г. отклонение реальной численности от расчетной было значительно больше. В этот год из-за аномальных ледовых условий наблюдалась массовая гибель не только молоди тюленей, но и значительного количества других животных, включая птиц и беспозвоночных (Русанова, Хлебович, 1967; Бианки, Карпович, 1969 и др.).
Начиная с 1980 г. реальный рост численности популяции лысуна, составлявший по данным авиационных учетов около 5% в год, замедлился и стал все больше отставать от прогнозируемого. В 1980 г. численность стада по данным аэрофотосъемок (Назаренко, 1984) была примерно на 200 тысяч голов ниже прогнозированной величины (около 1 млн. голов). Стало очевидно, что модель хорошо работала в тот период, когда популяция тюленей, освобожденная от воздействия чрезмерного промысла, находилась в состоянии бурного компенсаторного роста численности. Начиная приблизительно с 80х годов прошлого столетия, рост численности стали тормозить какие-то иные факторы, не имеющие отношения к промыслу, жестко регламентированному не только в тот период, но и в дальнейшем. До конца 80-х годов промышлялось около 70–80 тыс. тюленей за год. Затем добыча была сокращена до 40–45 тыс. шт. В 2002 и 2003 гг. промыслом изымалось в среднем примерно по 40 тыс. шт. в год (Стасенков, 1998; Отчет СевПИНРО, 2003).
Хотя воздействие промысла на популяцию лысуна значительно сократилось, оно не исчезло вовсе. Изменился его характер. С 60-х годов прошлого столетия началось переориентирование промысла на добычу тюленей возраста 0+ и 1+. На 2004 г ОДУ рассчитано в объеме 45.1 тысяч животных в возрасте 1+ или эквивалентного количества детенышей. Учитывая различия смертности тюленей в возрасте 0+ и 1+ при выборе сценария промысла, включающего добычу животных обеих возрастных групп, одного тюленя возраста 1+ предложено приравнивать к 2.5 детенышам (Отчет СевПИНРО, 2003). Аналогичные величины допустимого изъятия рассчитаны и на период с 2005 по 2007 гг.: 45100 голов животных в возрасте одного года (и старше) или 112750 детенышей (Доклад..., 2004).
Конечно, и без целенаправленного промыслового изъятия детеныши и молодые тюлени гибнут в большом количестве от ряда причин, к которым относятся неблагоприятные метеорологические условия, ледовая обстановка, недостаток кормов и др. Главным фактором, вызывающим гибель значительного числа новорожденных тюленей на детных залежках, является нарушение обычных путей миграции приплода (Тимошенко, 1995 а). Это бывает в том случае, когда после суровой зимы вынос льдов за пределы Белого моря задерживается ветрами северных направлений. В результате приплод лысуна не может своевременно достичь кромки льдов в Баренцевом море и погибает в большом количестве от истощения и переохлаждения. Такая ситуация, как уже отмечалось, имела место в 1966 г. при аномальной ледовой обстановке (Бианки, Карпович, 1969). Аналогичные случаи регистрировались в 1979, 1983 и 1998 гг. (Тимошенко, 2002). Некое подобие этого было и в 2001 г., когда из-за сильных северо-восточных ветров часть детенышей лысуна была вынесена на льдинах не в Баренцево, а во внутренние районы Белого моря. Ветра вскоре сменились на благоприятные, и больших отрицательных последствий для популяции гренландских тюленей эта история не имела, хотя средства массовой информации (например, газета «Известия» от 8 мая 2001г.) сообщали явно завышенные данные о гибели 200 ( ! ) тысяч детенышей лысуна в Кандалакшском заливе.
Как следствие этих воздействий, включающих промысел молодняка, в возрастной структуре беломорского стада гренландского тюленя произошли серьезные негативные изменения: популяция стала стареть.
Применительно к популяции лысуна принято считать, что годовалые особи в норме должны составлять 13–15% от общей численности тюленей (Федосеев, 1974). Между тем доля этой возрастной группы на линных залежках в Белом море составляла (Тимошенко, 2002):
а) в 1970–1979 гг. – 17.4%; б) в 1980–1989 гг. – 1.6%; в) в 1990–1994 гг. – 1.8%. В 1970–1979 гг. на линных залежках доля неполовозрелых зверей в возрасте от 1 до 4 лет была равна 47.4% , а в 1990–1994 гг. она составила в среднем 6.2% (Отчет СевПИНРО, 1997; Тимошенко, 2002). Одновременно с этим на детных залежках понизилась и доля размножающихся самок возраста от 4 до 9 лет. В 1970 г. она составляла 35.9%, а в 1993 г. – 18.4%.
Противофазные изменения касались животных старших возрастных групп. Увеличение их доли было зарегистрировано в 1970–1980-х годах при изучении численности самок в возрасте 21 год и старше (Яблоков, Назаренко, 1986; Мишин, 2001).
Общеизвестно, что старение животных приводит к снижению репродуктивных возможностей, увеличению смертности, повышению частоты рождения слабых, часто нежизнеспособных детенышей. В отношении гренландского тюленя наиболее выгодным для увеличения общей интенсивности размножения популяции считается (Назаренко, Белобородов, 1974) преобладание самок средневозрастных групп (младше 20 лет). Увеличение же доли старых животных (возраст более 21 года) снижает репродуктивный потенциал популяции.
Помимо этого, были зарегистрированы и такие отклонения в функционировании половой системы самок, как замедление темпов созревания фолликулов в яичниках и смещение сроков полового созревания, а также ряд других отрицательных морфофункциональных изменений (снижение упитанности и общей массы тела приплода и др.).
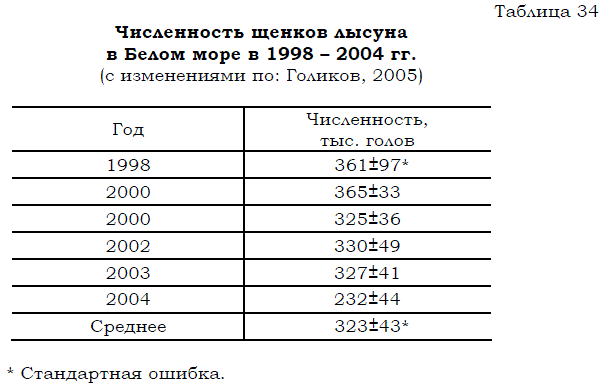
Несмотря на все эти негативные воздействия, численность стада продолжала постепенно увеличиваться. При этом аэрофотосъемка, остававшаяся единственным достаточно надежным методом учета численности гренландского тюленя, была переориентирована на определение количества не взрослых животных, а детенышей на щенных залежках. С 1998 по 2004 гг. численность щенков лысуна, согласно данным аэрофотосъемок варьировала от 365 до 232 тыс. голов (табл. 34). Общая численность беломорской популяции гренландского тюленя, рассчитанная на основании этих данных, оценивается в последние годы в 1.5–1.7 млн. голов (Кузнецов, 2004). По мнению специалистов из рабочей группы ИКЕС, запасы беломорского лысуна в 2000 г. находились в пределах от 1.5 до 1.9 млн. особей (цит. по: Гренландский тюлень..., 2001, с.162). Сходные величины (1.6 – 1.8 млн. голов), характеризующие нынешнюю численность беломорской популяции гренландского тюленя, приведены и в обзорном докладе Государственного комитета по рыболовству (Доклад..., 2004).
Таблица 34 Численность щенков лысуна в Белом море в 1998 – 2004 гг. (с изменениями по: Голиков, 2005)
* Стандартная ошибка.
Оценка численности популяции является одной из основных задач при управлении промыслом. Для анализа различных вариантов эксплуатации стада гренландского тюленя предлагается использовать различные имитационные модели, более или менее точно воспроизводящие динамику популяции и позволяющие прогнозировать изменения численности тюленей при различной стратегии промысла (Skaug, Oien, 2001; Коржев, 2004 и др.). С помощью одной из таких моделей было показано, в частности, что при существующей смертности сеголетков гренландского тюленя запрет промысла не приведет к восстановлению структуры и численности стада (Отчет СевПИНРО, 2003). При ежегодной добыче 40 тыс. животных численность популяции к 1998 г. сократится на 8%, при 30 тыс. – на 7%, в случае полного запрета промысла – на 5.8%.
Несмотря на достаточно высокую численность популяции лысуна, зарегистрированную в последние годы (около 1.7 млн. голов), его промысел нельзя считать рациональным и полностью сбалансированным. Для оптимизации половой и возрастной структуры беломорского стада гренландского тюленя можно использовать два пути управления демографической структурой популяции и соответствующей оптимизации промысла: сокращение квоты на забой детенышей и избирательное изъятие старых животных (Мишин, 2001). Второй вариант эксплуатации беломорской популяции гренландского тюленя был предложен (Яблоков, Назаренко, 1986) как перспективный путь перехода к рациональному промыслу.
Нестабильность популяции лысуна, по-видимому, будет сохраняться до тех пор, пока не восстановится численность объектов, являющихся их основной пищей в период нагула за пределами Белого моря. Лысуны откармливаются в основном в Баренцевом море. Их пища состоит главным образом из сайки и мойвы. Помимо этого, хотя и в значительно меньшем количестве, тюлени поедают сельдь, треску, навагу, песчанку и других рыб, а также ракообразных и крылоногих моллюсков (Виноградов, 1949; Чапский, 1961; Тимошенко, 1963; Markussen, Oritsland, 1985; Назаренко, 1986; Nilssen et al., 1994, 1995; Мишин, 2001 и др.). Пути нагульных миграций гренландских тюленей беломорской популяции могут изменяться в зависимости от того, насколько благоприятна кормовая ситуация в различных частях ареала.
До 60-х годов прошлого столетия тюлени покидали Белое море и откочевывали постепенно все дальше на север вместе с отступающей кромкой льдов, у которой создаются наилучшие условия для откорма ряда рыб
планктонофагов (Несветова, 2003) и где концентрировались мойва и полярная тресочка (сайка). При этом тюлени постепенно распределялись на акватории от Шпицбергена до Северной Земли.
С конца 70-х годов численность сайки и мойвы в Баренцевом море резкого сократилась главным образом из-за «перелова» (Матишов, 1990, 1994). Как следствие этого, гренландские тюлени стали появляться в прибрежье Мурмана и Северной Норвегии, где и проводят часть своего нагульного периода (Попов, 1989; Haug et al., 1991, 1994; Кондаков, Краснов, 1996; Galaktionov, 2001b). При этом они питаются в основном креветками, сельдью, бычками, треской, камбалами и липарисами. Поедают и пелагических амфипод Parathemisto libellula (Lydersen et al., 1991).
В 1979–1988 гг. при вызванных бескормицей массовых подходах тюленей к берегам Норвегии в сетях, тралах и других орудиях рыбного промысла погибло до 200 тыс. тюленей. Это были преимущественно молодые животные (Wiig, 1988; Haug et al., 1991). Подходы тюленей в прибрежные районы северной Норвегии продолжались и многие годы спустя, хотя и в меньших масштабах (Гренландский тюлень..., 2001).
В августе–ноябре тюлени нагуливают в Гренландском море, на севере Баренцева и Карского морей, а позже спускаются на юг вдоль Новой Земли. Перед заходом в Белое море они откармливаются в Печорском море на скоплениях сайки, пришедшей сюда на нерест (Nilssen et al., 1994). Показателен в связи с этим необычный массовый заход тюленей зимой 1982–1983 гг. в эстуарий р. Койда (Мезенский залив) в тот момент, когда сюда в массе подошла навага. Такую миграцию части популяции в Белое море задолго до начала деторождения следует рассматривать не иначе как нагульную и вызванную бескормицей в Баренцевом море (Тимошенко, 1995а).
Приведенные выше сведения об изменениях запаса, структуры популяции и характера нагульных миграций лысуна свидетельствуют о том, что состояние стада этих тюленей в значительной степени зависит не только от условий обитания в Белом море, где они размножаются и линяют: не менее важен и период нагула, проходящий далеко за пределами Белого моря. Благосостояние беломорской популяции гренландского тюленя во многом определяется состоянием экосистем Баренцева, Норвежского и Карского морей. Таким образом, на основании этого примера можно утверждать, что между экосистемами всех этих морей, включая Белое море, существуют тесные связи, объединяющие их в некую единую систему более высокого уровня организации. Подтверждением этому служат и приведенные выше (см. гл. 5, 6) факты массовых миграций ряда рыб (сайки, сельди, мойвы и др.) и птиц из Баренцева моря в Белое и обратно.
Кольчатая нерпа Pusa hispida Schreber – относительно небольшой тюлень, достигающий в длину 130 см при массе около 60 кг (Огнетов и др., 2003). Нерпа распространена повсеместно по всему Белому морю. Тюлени встречаются главным образом в прибрежной зоне моря, могут заходить в устья рек, часто поднимаясь против течения на значительные расстояния. Пространственное распределение нерпы носит пятнистый характер: места локальных скоплений чередуются с участками, где встречаются единичные особи или тюлени вообще отсутствуют (Огнетов и др., 2003). Наибольшее количество животных держится постоянно в Онежском заливе, а в остальных частях моря их обычно значительно меньше.
Распределение нерпы меняется по сезонам. Зимой тюлени скапливаются в основном на припайных льдах Кандалакшского, Онежского и Двинского заливов. В летнеосенний период они распределены по прибрежной и островной зонам всего моря. В это время они довольно многочисленны и в Воронке, где скапливаются на отмелях.
Обычно нерпы держатся поодиночке, образуя временные скопления на льду только в период спаривания и линьки. Зимой они проделывают и поддерживают как узкие отверстия для дыхания («продухи»), так и более широкие, через которые вылезают на лед для отдыха. Самки устраивают в сугробах на поверхности припайного льда (обычно в местах его торошения) скрытые снежные норы («логовища») с единственным входом/выходом из воды. Здесь в конце февраля–начале марта появляются на свет новорожденные нерпы. Основные места размножения кольчатой нерпы расположены в районе Соловецких островов и в Кандалакшском заливе.
Численность популяции нерпы в значительной степени определяется выживаемостью приплода, которая в свою очередь зависит в основном от пресса хищников и климатических условий. В Белом море основными врагами молоди тюленей являются лисы и волки. Так, например, в прибрежных водах Соловецкого архипелага до 30% детенышей кольчатой нерпы уничтожают лисицы. Аналогично этому в Карском море до 40% щенных логовищ нерпы разрушается белым медведем, и около 30% детенышей уничтожается песцами (Потелов и др., 1986). В канадском секторе Арктики и в районе Шпицбергена белый медведь и песец разрушают до 73% снежных нор-логовищ и поедают детенышей нерпы (Lydersen, Giertz, 1986; Furgal et al., 1996).
Что касается влияния гидрометеорологических условий, то они сказываются в основном в период вскрытия припайного льда. Его раннее разрушение вызывало в отдельные годы гибель от 20 до 55% приплода нерпы в разных частях Белого моря (Лукин, 1980; Потелов и др., 1986).
Молочное кормление приплода длится около месяца, после чего у взрослых животных наступает период спаривания, а затем и линьки. В это время нерпы, исключая приплод, образуют разреженные залежки на льдах или суше. Продолжается линька не менее месяца. Тюлени в этот период не питаются и теряют в весе (Тимошенко, 1995 б). В период нагула основу питания нерпы составляют стайные рыбы и ракообразные (Виноградов, 1949; Тимошенко, 1995 б). Летом и осенью нерпы любят залегать на обнажающихся во время отлива песчаных отмелях («кошках»), выступающих из воды валунах и каменистых грядах. Самые крупные скопления нерп численностью около 500 голов отмечены осенью в южной части Воронки (Тимошенко, 1995 б). Залежки нерпы зарегистрированы также в районе Соловецких островов, в Кандалакшском заливе и других местах.
Стадо беломорской нерпы находится в удовлетворительном состоянии в течение всего последнего времени, что в первую очередь обусловлено слабо развитым промыслом этих тюленей. Они не образуют таких доступных для промысла скоплений, как, например, гренландский тюлень, морж и другие виды морских млекопитающих. Одиночный образ жизни и осторожность делают нерпу мало доступной для активного промысла (Огнетов и др., 2003).
В 80-х годах прошлого столетия на Белом море добывалось ежегодно приблизительноо 1.5 тысячи нерп. В 2002 и 2003 гг. промысел сократился в 3–4 раза. За год добывалось не более 400–500 голов (Стасенков, 1998; Отчет СевПИНРО, 2003).
По разным оценкам численность кольчатой нерпы в Белом море составляет от 20 до 35 тыс. особей. В 70-х годах прошлого века ее численность оценивали на ледовых залежках в период размножения величиной в 24–30 тыс. особей (Тимошенко, 1995 б). Учет, произведенный по открытой воде в июне 1993 г., дал величины от 17 до 31 тыс. животных (Светочев, Светочева, 1995). Определения, выполненные летом 2003 г., свидетельствуют о том, что численность нерпы составляла 18–21 тыс. голов (Отчет СевПИНРО, 2003). Таким образом, есть все основания полагать, что численность нерпы в Белом море является относительно постоянной. Она поддерживается на уровне не менее 20 тыс. особей (Огнетов, 2002; Огнетов и др., 2003).
Белуха Delphinapterus leucas Pallas – самое крупное млекопитающее из тех, которые постоянно обитают в Белом море. Эти дельфины получили свое название, благодаря белоснежной окраске взрослых особей.
Существуют различные точки зрения на внутривидовую структуру этих животных. Выделяется до 16 популяций и 3 различных вида в пределах рода Delphinapterus, однако этот вопрос еще весьма далек от своего окончательного решения. Наиболее вероятно, как считают Г.Г. Матишов и Г.Н. Огнетов (2006), что белухи, обитающие в акваториях Баренцева, Белого и Карского морей и заходящие в море Лаптевых, принадлежат к единой популяции D. leucas leucas Pall, 1776.
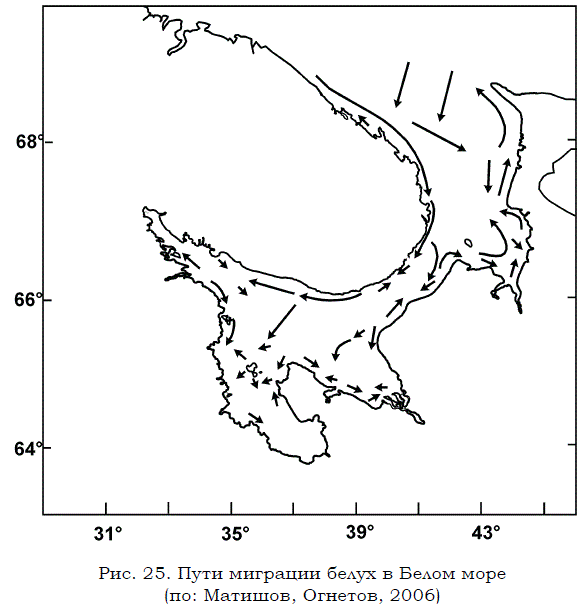
Белухи встречаются по всему Белому морю, но их распределение меняется в разные сезоны (Огнетов, 1995). На зиму они, как правило, покидают южные районы и уходят в Баренцево море (рис. 25). Часть белух, однако, зимует в Горле и Воронке, где держится крупными скоплениями (до 100–300 шт.), небольшими группами или поодиночке. В теплые зимы при достаточном количестве пищи небольшие стада в несколько десятков голов остаются в Двинском, Онежском и Кандалакшском заливах.
Рис. 25. Пути миграции белух в Белом море (по: Матишов, Огнетов, 2006)
В весенне–летний период численность белухи в Белом море возрастает в результате ее захода из Баренцева моря. Часть животных мигрирует вдоль Терского берега Горла, заходя в Кандалакшский и Онежский заливы, а другие вдоль Зимнего берега Горла проникают в акваторию Двинского залива. Летом численность белухи в Белом море достигает максимума. Со второй половины лета начинается обратная миграция белухи в Баренцево и Карское моря. При этом ее численность в Белом море снова падает. К концу ноября остаются лишь небольшие группы и одиночные животные.
Деторождение начинается весной и может продолжаться все лето (Клейнеберг и др., 1964). В июне самок с детенышами очень мало (менее 5%), а в июле на их долю приходится 15–20% от общей численности скапливающихся животных (Потелов, Огнетов, 1974).
Основную роль в питании белух играют массовые стайные рыбы: сайка, мойва, сельдь, навага, корюшка, камбалы, песчанка и др., а дополнительную – рыбы других видов и беспозвоночные животные (креветки, моллюски, полихеты).
В Белом море белухи питаются в основном сельдью и мойвой, и в меньшей степени – корюшкой, навагой, пинагором и треской. Из-за резкого снижения численности мойвы в настоящее время ее роль в откорме белухи, повидимому, минимальна. Из ракообразных они поедают в Белом море в значительном количестве лишь креветок Crangon crangon. Чем белухи питаются в зимний период, остается до конца не выясненным. Скорее всего, основу их пищи в это время года составляет сайка (Виноградов, 1949). На Белом море промысел белух ради жира, шкур и мяса велся в течение столетий и даже тысячелетий, о чем, как уже отмечалось, свидетельствуют археологические данные (Кузнецов, 1960). Поморы успешно добывали белух во время гарпунной охоты уже в IX веке (Брейтфус, 1905). В XVI веке в Белом море их промышляли специальные артели с обметными неводами (Кречков, 1924).
Особого развития промысел достиг в конце XIX– начале XX вв. Его вели в основном в летнее время (в июне– августе), загоняя животных на мелководья и окружая их неводами, длина которых достигала 2 км с лишним (Максимов, 1984). Количество ежегодно добываемых белух варьировало от нуля (1978 г.) до 850 шт. (1970 г.), что до недавнего времени зависело в основном от численности заходящих в Белое море зверей. Средняя добыча с 1946 по 1985 гг. составила 231 экз./год (Огнетов, 1995).
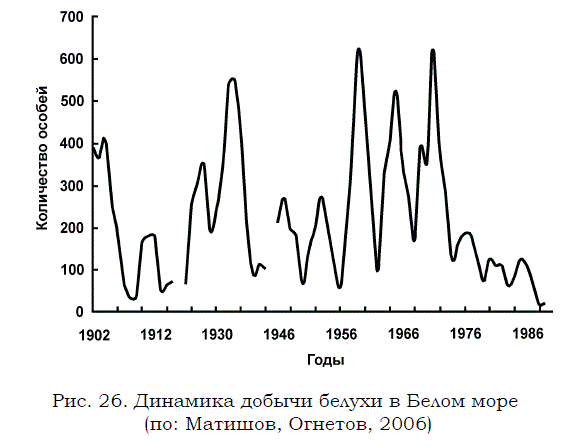
При более детальном изучении динамики добычи белухи в Белом море весь имеющийся ряд статистических данных за период немногим менее 100 лет был обработан методом сглаживания по трехлетиям (рис. 26).
Эти многолетние данные указывают на значительные периоды подъемов и спадов добычи, которые хорошо согласуются с соответствующими изменениями в динамике заходов белухи в акваторию Белого моря. При этом необходимо отметить, что связь объемов добычи с мощностью заходов белухи можно проследить лишь до второй половины 60-х годов прошлого столетия, т.е. до тех пор, пока промысел велся достаточно интенсивно.
Рис. 26. Динамика добычи белухи в Белом море (по: Матишов, Огнетов, 2006)
В 70–80-х годах его интенсивность понизилась. На многих промысловых участках добыча белухи прекратилась вовсе. Так, если в 30–40-х годах прошлого столетия на западном побережье полуострова Канин функционировало 5 таких участков, то в 50-х годах сохранился лишь один – пос. Тарханово. В конце 80-х годов во всем море лов белухи производился только в двух местах: с. Гридино и пос. Тарханово. Начиная с 1990 г., промысел белухи в Белом море прекратился полностью (Огнетов, 1995).
Белухе свойственна высокая миграционная активность, что связано, в первую очередь, с поисками кормовых объектов: в Белом и Баренцевом морях это в основном – треска, мойва и сельдь, а в Карском море – сайка. Весной белухи мигрируют в Белое море, а в августе–сентябре в массе покидают его. Динамика заходов имеет шестилетний цикл, стабильно повторяющийся многие годы (Огнетов, Потелов, 1978).
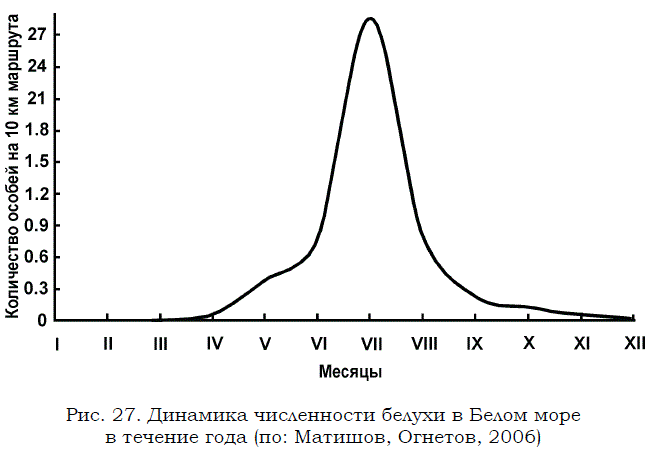
В связи с миграциями численность белухи в Белом море непостоянна и значительно изменяется по сезонам (рис. 27).
Рис. 27. Динамика численности белухи в Белом море в течение года (по: Матишов, Огнетов, 2006)
В зимний период распределение животных зависит от ледовой обстановки, режим которой значительно отличается в разные годы, делая тем самым одни районы пригодными, а другие – не подходящими для обитания. Весной количество регистрируемых животных увеличивается. Так, в апреле 1985 г. плотность белух не превышала 0.15 экз./100 км2, а в мае возросла до 2.4 экз./100 км2. В отдельные годы она может достигать в это время 6.1 экз./100 км2.
Летом белухи рассредоточиваются по всему морю. Повышенная плотность наблюдается в его южной части, а более низкая – в северной. Наивысшие показатели были зарегистрированы в Онежском и Двинском заливах: 33 и 42.5 экз./100 км2 соответственно. Максимальная плотность распределения животных отмечена в июне.
В разные годы численность белухи в Белом море также непостоянна. В среднем в расчете на год она варьировала от 232 шт. в 1975 г. до 2500–3000 особей в 1986 г. (Огнетов, 1987). Согласно результатам многолетних наблюдений численность белухи в Белом море колеблется от 200– 300 до 2000–3000 особей (Митибаева и др., 1991). В Кандалакшском заливе общая численность белухи в летнее время, на основе учетов 1986–1990 гг., оценивалась в 100–200 голов (Бойко, Шкляревич, 1997).
Наблюдения, проведенные с самолета в 2000 г., показали, что в Белом море находилось от 900 до 1100 белух. Аналогичные данные (около 1100 особей) были получены и год спустя. По результатам береговых наблюдений численность белухи в Белом море была определена в 2111 шт. При этом на долю детенышей приходилось порядка 13% от общей численности стада, что свидетельствовало о его хорошем состоянии. Судовые учеты летом 2002 и 2003 гг. показали, что в Белом море находилось соответственно 3145 и 2125 белух (Бондарев, 2005).
С помощью математического моделирования, учитывая общую численность популяции Белого, Баренцева и Карского морей (около 20–25 тыс. голов) и естественную смертность, был рассчитан уровень допустимого изъятия. Общий ОДУ на всю популяцию на 2005 г. определен на уровне 600 голов. При этом оговаривается (Отчет СевПИНРО, 2003), что популяция, несмотря на отсутствие промысла в последние годы, еще не приблизилась к своей первоначальной численности, поэтому для определения уровня устойчивого изъятия необходимы дополнительные данные, характеризующие состояние популяции в настоящее время и его динамику на протяжении длительного отрезка жизненного цикла.
Морской заяц Erignatus barbatus Erxl. распространен по всему морю, но в наибольшем количестве обитает в Воронке и Мезенском заливе. С весны до поздней осени тюлени держатся поодиночке в прибрежной мелководной зоне, а зимой – в незамерзающих местах с быстрым течением. На сплошных ледяных полях обитают редко (Карпович, 1984).
Рождение детенышей морского зайца происходит в апреле на льду в Воронке и Мезенском заливе. После трехнедельного молочного вскармливания тюленят самками половозрелые особи спариваются, а затем линяют. В течение всего этого времени тюлени не питаются.
Основу питания морского зайца составляют моллюски, а на втором месте стоят креветки. Сайку, бычков, мойву и других рыб эти тюлени потребляют значительно реже и в меньшем количестве (Виноградов, 1949).
Специализированного промысла морских зайцев на Белом море никогда не было. Обычно их добывали вместе с гренландским тюленем или нерпой в количестве от 13 до 30 экз.в год (Виноградов, 1949).
В целом для акватории Белого моря численность морского зайца в июне 1993 г. была определена в 2900–4100 голов (Светочев, Светочева, 1995). По-видимому, не будет ошибкой утверждение о том, что беломорская популяция этого вида морских млекопитающих находится в более или менее благополучном состоянии.
Морж Odobenus rosmarus rosmarus L. был несколько столетий назад достаточно многочислен на Белом море. Его промышляли в большом количестве (Кузнецов, 1960; Galaktionov, 2001 b). Сейчас моржи встречаются единично или группами от 2 до 5 животных в основном в Воронке и Горле, изредка проникая и во внутренние участки акватории моря (Попов, Назаренко, 1977; Краснов, 2005; Светочев, Светочева, 2007 и др.).
Хохлач Cystophora cristata Erxl. и серый тюлень Halichoerus grypus Fabricius также встречаются в Белом море лишь эпизодически (Тимошенко, 1995 в; Кондаков, 1997; Клепиковский и др., 2005).
К числу других морских млекопитаюших, изредка встречаемых в Белом море, принадлежат морская свинья Phocoena phocoena L., касатка Orcinus orca L., малый поласатик или кит Минке Balaenoptera асutorostrata L., финвал B. physalus L., сейвал B. borealis borealis Lesson, кашалот Physeter catodon L. и бутылконос Hyperoodon ampullatus Forster.